Selon le co-fondateur de Concenter BioPharma et le professeur CSO
Mottie (Mordechai) Chevion, « la propriété unique » du médicament, appelé Zygosid-50 « est qu’il annule la résistance à l’insuline. »
« C’est un médicament antidiabétique », a-t-il déclaré au Jerusalem Post lors d’une interview jeudi après-midi.
Il a expliqué que la cause du diabète de type 2 n’est pas entièrement comprise, ajoutant qu’il existe plusieurs facteurs tels que l’obésité, le mode de vie, la consommation d’aliments malsains et le vieillissement qui ont conduit à une augmentation des incidents de diabète de type 2.
« Il existe également une relation avec l’ethnicité, les antécédents familiaux et les dispositions multigéniques », a-t-il déclaré. « C’est une combinaison de facteurs génétiques et de déclencheurs environnementaux, bien qu’il existe des différences entre les différentes régions [du monde]. »
Chevion a déclaré que selon les dernières statistiques de décembre 2019, environ 463 millions de personnes dans le monde ont reçu un diagnostic de diabète.
« De ce nombre, jusqu’à 95% ont le type 2 », a-t-il déclaré. « D’ici 2045, nous aurons une augmentation de 51% du diabète, ce qui signifie que 700 millions de personnes auront été diagnostiquées. »
Le plus inquiétant, a déclaré Chevion, est qu’au Moyen-Orient et en Afrique du Nord, il y a environ 55 millions de personnes atteintes de diabète, ce qui passera à 108 millions d’ici 2045.
« Il s’agit d’une augmentation de 96% », a-t-il souligné. «Il y a 31 millions de personnes aux États-Unis avec le diabète, mais plus de 90 millions de personnes prédiabétiques. «
Il a dit qu’il est « dévastateur et alarmant qu’il n’y ait pas de remède et que, en général, le diabète s’aggrave avec l’âge ». Tous ces chiffres sont ceux qui souffrent de diabète à part entière, et pour chaque personne qui l’a contracté, il y a deux ou trois personnes prédiabétiques. »
Cela signifie que « un sur trois ou quatre de la population générale est prédiabétique, ce qui souligne qu’un tiers, voire la moitié d’entre eux pourraient devenir diabétiques dans les cinq à dix prochaines années ».
Le coût économique du traitement du diabète, a-t-il dit, qui comprend le traitement, les séjours à l’hôpital, les amputations et les heures de travail perdues, s’élève à plus de 850 milliards de dollars par an.
« Avec Zygosid-50, nous proposons l’utilisation du nouveau médicament et nous le développons dans une pilule orale, en tant que médicament de monothérapie, pour traiter les diabétiques et prévenir chez les patients pré-diabétiques », a déclaré Chevion. « Pendant de nombreuses années, les gens n’ont pas reconnu que la racine du diabète est la résistance à l’insuline – c’est devenu un fait très clair. »
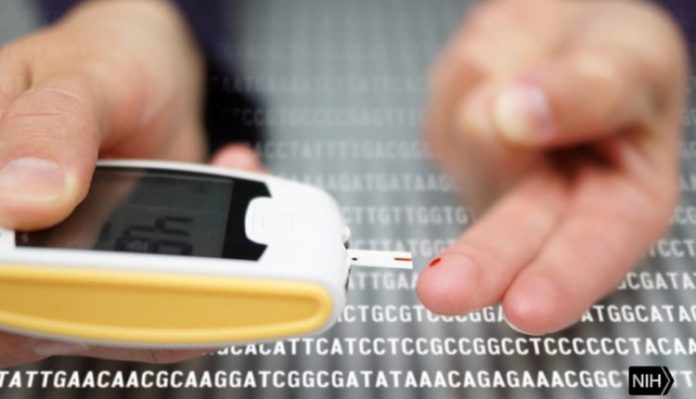
Le diabète fait que la glycémie, également appelée glycémie, est trop élevée. La glycémie est la principale source d’énergie d’une personne et provient de la nourriture.
L’insuline, une hormone produite par le pancréas, aide le glucose contenu dans les aliments à atteindre les cellules pour être utilisé comme énergie.
« Cela signifie que pour le même niveau d’insuline qui est produit, il n’y a pas assez d’infiltration de glucose dans les muscles … l’insuline est ce qui facilite l’infiltration de glucose dans ses principaux clients, qui sont les muscles », a expliqué Chevion. « [Le diabète survient lorsque] l’insuline n’est pas capable de résister à l’infiltration de glucose dans les muscles. »
Il a souligné que le diabète est multiorganique
Lorsqu’on lui a demandé comment fonctionnait le Zygosid-50, il a répondu « qu’il réduit presque complètement la résistance à l’insuline et normalise tous les paramètres associés au diabète dans la plage normale ».
« Si la résistance à l’insuline est prise en charge, les symptômes sont pris en charge », a-t-il déclaré.
Il a souligné qu’ils n’avaient trouvé aucun effet secondaire indésirable lors de leurs tests.
« Ce que nous avons découvert sur Zygosid-50 nous permet d’entrer dans des essais cliniques », a-t-il expliqué, expliquant que la Food and Drug Administration américaine. a approuvé des essais cliniques, après des études TOX complémentaires, sur la base de preuves issues de tests précédents sur des modèles animaux pour le diabète de type 2.
« Il a été prouvé qu’il était » sûr « », a déclaré Chevion au Post. « Nous avons constaté qu’il restaure une sensibilité à l’insuline normale, restaure les niveaux de glucose dans le sang, normalise également le test de tolérance au glucose », qui mesure la réponse du corps au sucre « , et supprime l’inflammation systémique, qui est un composante du diabète. «
Chevion a ajouté qu’au niveau moléculaire, « Zigosid-50 … force un échange intracellulaire à se produire », où il supprime ce qu’on appelle le « fer libre » des cellules et le remplace par du zinc.
« Il capture le fer » libre « dans la cellule et libère la même quantité de zinc dans la cellule – il les alimente en zinc », a-t-il déclaré, ajoutant qu’une carence en zinc a souvent été constatée chez les personnes souffrant de diabète.
Il a précisé que le zinc est nécessaire pour certaines voies dans les processus liés au diabète dans le corps.
Chevion a découvert que Zygosid-50 est efficace dans la lutte contre l’inflammation topique de la peau et que même en utilisation continue, il n’y a pas d’effets secondaires négatifs.
Interrogé sur BioPharma, Chevion a déclaré qu’il a été créé en 2019 en tant que filiale de Silkim Pharma, qui détient les propriétés intellectuelles des brevets des inventeurs.
En décembre, Chevion a remporté la première place au 17e Congrès mondial annuel sur la résistance à l’insuline, le diabète et les maladies cardiovasculaires pour son travail à Zygosid-50.
Lorsqu’on lui a demandé ce qui l’attend en 2020, il a répondu qu’ils étaient en train de lever 5 millions de dollars pour effectuer une étude TOX supplémentaire et poursuivre les essais cliniques chez l’homme.
« Nous espérons atteindre cet objectif bientôt », a déclaré Chevion. « Une fois que nous aurons réussi, nous pourrons commencer les répétitions en quelques semaines. »
« Nous sommes prêts », a-t-il conclu, ajoutant qu’ils prévoyaient de mener des études cliniques (phases I et IIa) dans deux hôpitaux en Israël, puis de soumettre une demande de recherche d’un nouveau médicament à la FDA pour de nouvelles études.
Par: Ilanit Chernick / Dans: Jpost / Traduction Infos Israel News