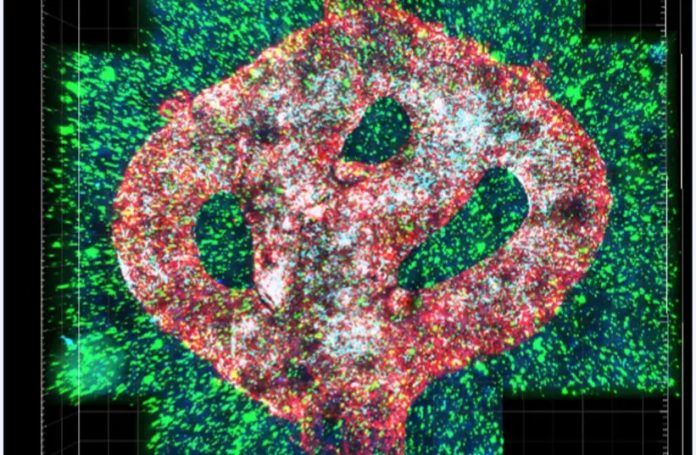
Une équipe de chercheurs israéliens de l’Université de Tel Aviv a imprimé la première tumeur cérébrale maligne viable au monde à l’aide d’une imprimante 3D, recréant les vaisseaux sanguins en écoulement et le tissu cérébral environnant.
La tumeur du glioblastome est basée sur des échantillons de patients prélevés lors d’une intervention chirurgicale et est entourée d’un système complexe de tubes ressemblant à des vaisseaux sanguins à travers lesquels des cellules sanguines et des médicaments peuvent circuler, simulant une véritable tumeur, a expliqué le professeur Ronit Satchi Fainaro, qui a dirigé l’enquête.
Le glioblastome est le type de cancer du cerveau le plus mortel.
Le modèle 3D pourrait aider à accélérer la découverte et le développement de médicaments ou de cibles médicamenteuses, et faciliter un nouveau niveau de médecine personnalisée pour les patients, permettant une prédiction plus rapide et plus robuste des traitements les plus appropriés.
La recherche a été publiée mercredi dans la revue à comité de lecture Science Advances. Il a été réalisé en collaboration avec la doctorante Lena Neufeld. L’étude a été financée par la Fondation Morris Kahn, le Conseil européen de la recherche, le Fonds israélien de recherche sur le cancer, l’Association israélienne du cancer, la Fondation israélienne pour la science et Check Point Software Technologies.
Jusqu’à présent, les cellules cancéreuses étaient cultivées dans des boîtes de Pétri en plastique 2D.
« Je mettrais 1 000 cellules chacune dans deux boîtes de Pétri et en traiterais une avec un agent chimiothérapeutique », a déclaré Satchi-Fainaro. « Le lendemain, ou trois jours plus tard, je m’attends à voir les cellules traitées diminuer à 10% des cellules d’origine, tandis que le contrôle continuera à se multiplier chaque jour. »
Lorsque les résultats étaient bons, les chercheurs sur le cancer ont transféré l’agent à la clinique.
« Nous testons de nouveaux médicaments comme celui-ci depuis au moins trois à quatre décennies, moi y compris », a expliqué Satchi-Fainaro. Mais il a dit que 90 composés sur 100, lorsqu’ils sont déplacés du laboratoire vers la clinique, ne fonctionnent pas.
« C’est scandaleux ! Et cela signifie que quelque chose ne va pas. J’ai commencé à me demander. Je suis arrivé au point de penser que nous travaillions peut-être avec le mauvais modèle de cancer ».
Ce qui a vraiment alerté Satchi-Fainaro, c’est une étude antérieure qu’il a récemment achevée dans laquelle son équipe a identifié une protéine appelée P-Selectin, produite lorsque les cellules cancéreuses du glioblastome rencontrent les cellules du système immunitaire du cerveau.
« Nous avons découvert que cette protéine est responsable d’une défaillance de la microglie, les obligeant à soutenir plutôt qu’à attaquer les cellules cancéreuses mortelles, aidant ainsi le cancer à se propager », a-t-il déclaré. « Cependant, nous avons identifié la protéine dans les tumeurs retirées pendant la chirurgie, mais pas dans les cellules de glioblastome cultivées dans des boîtes de Pétri en plastique 2D dans notre laboratoire. »
LE MODÈLE est composé de cellules cancéreuses et recrée également le « microenvironnement dans le cerveau » : cellules gliales spécialisées, cellules effectrices immunitaires innées primaires du système nerveux central et vaisseaux sanguins.
Les vaisseaux sont connectés à un système de tubes à travers lesquels l’équipe peut acheminer des globules rouges et blancs et différents médicaments vers le modèle tumoral afin de mieux prédire ce qui est efficace.
« Chaque modèle est imprimé dans un bioréacteur que nous avons conçu en laboratoire à partir d’un hydrogel prélevé et reproduit à partir de la matrice extracellulaire extraite du patient, simulant ainsi le tissu lui-même.
« Les propriétés physiques et mécaniques du cerveau sont différentes de celles d’autres organes, comme la peau, la poitrine ou les os.
Le tissu mammaire est composé principalement de graisse; le tissu osseux est principalement composé de calcium. Chaque tissu a ses propres propriétés, qui affectent le comportement des cellules cancéreuses et leur réaction aux médicaments », a déclaré Satchi-Fainaro.
Il a déclaré que le modèle recrée en fait des propriétés mécaniques cruciales de la tumeur et de l’environnement dans lequel elle se développe, telles que la plasticité et l’élasticité.
Après la création du modèle, l’équipe a essayé de démontrer pourquoi il fonctionne mieux que les plaques en plastique 2D.
« Tout d’abord, nous avons testé une substance qui inhibait la protéine récemment découverte, la P-Sélectine, dans des cultures de cellules de glioblastome cultivées dans des boîtes de Pétri 2D, et nous n’avons trouvé aucune différence dans la division cellulaire et la migration entre les cellules traitées et les cellules de contrôle qui n’ont reçu aucun traitement. , a expliqué Satchi-Fainaro. « Au contraire, à la fois dans les modèles animaux et dans les modèles bio-imprimés 3D, qui surexpriment la protéine, nous avons pu retarder la croissance et l’invasion du glioblastome en bloquant la protéine P-Selectin. »
L’équipe a ensuite effectué un séquençage génétique des cellules cancéreuses cultivées dans le modèle 3D et les a comparées à celles cultivées dans la boîte de Pétri et le cerveau d’un patient. L’expérience a montré une bien plus grande similitude entre les tumeurs bio-imprimées en 3D et les cellules du patient, par rapport à celles cultivées dans du plastique.
« Au fil du temps, les cellules cancéreuses qui se sont développées dans le plastique ont considérablement accroché, perdant finalement toute ressemblance avec les cellules cancéreuses de l’échantillon de tumeur cérébrale du patient », a déclaré Satchi-Fainaro.
Enfin, ils ont mesuré le taux de croissance de la tumeur.
« Le glioblastome est une maladie agressive en partie parce qu’elle est imprévisible. Lorsque des cellules cancéreuses hétérogènes sont injectées séparément dans des animaux modèles, le cancer restera latent chez certains, tandis que chez d’autres, une tumeur active se développera rapidement », a-t-il déclaré.
Dans la plaque, toutes ces tumeurs se développent à la même vitesse, tandis que dans la tumeur 3D, l’hétérogénéité est maintenue.
Satchi-Fainaro a déclaré qu’il avait fallu cinq ans à l’équipe pour créer la tumeur bio-imprimée en 3D.
« Nous avons eu beaucoup de difficultés et de défis en cours de route », a-t-il déclaré.
Mais maintenant, ils espèrent que cette percée changera à jamais la recherche sur le cancer.
« Si nous prélevons un échantillon du tissu d’un patient, ainsi que sa matrice extracellulaire, nous pouvons bioimprimer en 3D à partir de cet échantillon 100 petites tumeurs et tester de nombreux médicaments différents dans diverses combinaisons pour découvrir le traitement optimal pour cette tumeur spécifique », a déclaré Satchi-Fainaro . . . . « Alternativement, nous pouvons tester de nombreux composés dans une tumeur bio-imprimée en 3D et décider lequel est le plus prometteur pour un développement et un investissement ultérieurs en tant que médicament potentiel.
« Mais peut-être l’aspect le plus excitant est de trouver de nouveaux gènes et protéines cibles de médicaments dans les cellules cancéreuses, une tâche très difficile lorsque la tumeur se trouve dans le cerveau d’un patient humain ou d’un animal modèle. »
Elle a déclaré que le plan ultime était de créer d’autres sites tumoraux comme ils l’ont fait pour le glioblastome, comme les tumeurs cérébrales qui se développent à des stades avancés du cancer du poumon ou du sein. Ils démarrent un essai clinique au Sheba Medical Center de Tel Hashomer pour valider cette technique. Si, après trois à six mois, le patient et le modèle répondent de manière cohérente aux traitements, « imaginez combien de temps et d’argent nous allons économiser », a déclaré Satchi-Fainaro.
« Notre innovation nous donne un accès sans précédent, sans limite de temps, à des tumeurs 3D qui imitent mieux le cadre clinique, permettant une recherche optimale. »