Le virus COVID-19 monopolise les inquiétudes et les peurs de l’humanité depuis un an, mais il existe également des parasites unicellulaires qui causent des maladies dangereuses qui affectent des millions de personnes dans le monde. Les coupables sont les trypanosomes, qui provoquent des maladies majeures telles que la maladie du sommeil et la Leishmaniose («Rose de Jéricho».
Ces parasites sont transmis aux mammifères par la mouche tsé-tsé suceuse de sang. L’escale du parasite chez l’insecte-hôte se déroule en deux étapes. Ils vivent dans l’intestin de l’insecte pendant deux à trois semaines, puis migrent vers les glandes salivaires. Lorsque la mouche mange son prochain repas, les parasites sont transférés via la salive à la proie, infectant sa circulation sanguine. De cette manière, les mammifères tels que les hyrax des rochers – les animaux à fourrure à queue courte deviennent les hôtes des parasites et la maladie se propage.
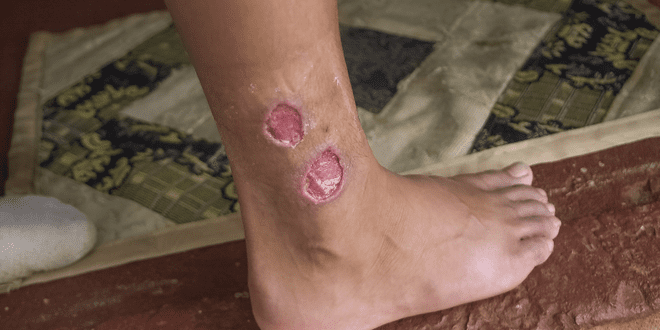
La leishmaniose s’est propagée périodiquement vers l’ouest de la vallée du Jourdain d’Israël (d’où le nom de Jéricho) aux villes et villages de Tibériade à Dimona. L’infection peut endommager le foie et la rate et provoquer une anémie, tandis que les plaies peuvent provoquer des cicatrices permanentes et laides si elles ne sont pas traitées.
Des phlébotomes infectés ont été identifiés dans les zones chaudes autour du lac Kinneret (la mer de Galilée), sur les collines de Judée et de Samarie, et dans le centre de la Galilée, la vallée de Beit She’an, le Gush Etzion, Elkana, le Ramat Hanegev et l’Arava. Mais la Rose of Jericho touche plus de six millions de personnes dans près de 100 pays, avec un million ou plus de personnes infectées chaque année.
La trypanosomiase humaine africaine, également connue sous le nom de maladie du sommeil, est une maladie parasitaire à transmission vectorielle causée par une infection par des parasites protozoaires appartenant au genre Trypanosoma. Ils sont transmis à l’homme par des piqûres de glossines qui ont contracté leur infection d’êtres humains ou d’animaux hébergeant des parasites pathogènes humains.
Désormais, une molécule qui vient d’être découverte par des chercheurs de l’Université Bar-Ilan (BIU) à Ramat Gan (près de Tel Aviv) pourrait accélérer le développement de médicaments pour traiter et prévenir la propagation de maladies telles que la maladie du sommeil et la leishmaniose.
Prof. Shulamit Michaeli, vice-président de la recherche et membre du corps professoral de la faculté des sciences de la vie Goodman de la BIU
Le professeur Shulamit Michaeli, vice-président de la recherche et membre du corps professoral de la faculté des sciences de la vie Goodman de BIU a fait des progrès significatifs dans la compréhension des fonctions internes des trypanosomes. Elle et ses collègues ont identifié une molécule d’ARN non codant (ARNc) qui régule la traduction des protéines chez le parasite. Cette découverte a été récemment publiée dans la revue iScience sous le titre « Novel Non-coding Anti-sense Regulators of Developmentally Regulated of MRNA Translation in Trypanosoma brucei ».
Toutes les protéines, qui déterminent les traits héréditaires, sont codées dans l’ADN – «verrouillé» dans le noyau de la cellule – qui est à peine perméable. Ainsi, l’une des fonctions importantes de l’ARN est de transporter les informations stockées dans l’ADN du noyau à l’intérieur de la cellule vers les ribosomes à l’extérieur de la cellule. Ceci est accompli grâce à l’ARN messager (ARNm), une copie de l’ADN qui pénètre dans les ribosomes. Les ribosomes ressemblant à des usines traduisent ensuite ces informations et synthétisent des protéines. C’est le modèle selon lequel les protéines sont fabriquées.
Le ribosome est composé d’ARN ribosomal (ARNr) et de protéines. Des molécules supplémentaires régulent également son activité. Une de ces molécules est l’ARN non codant (ARNc), qui contrôle la fonction de l’ARNm et détermine si les molécules d’ARNm survivent ou se dégradent et si elles sont ou non traduites en protéines.
La molécule d’ARNc identifiée par Michaeli provient du gène qui code pour l’ARNr. Lorsque l’ARNr est traité dans la cellule, les domaines inutiles de l’ARN sont épissés ou traités. Ces domaines subissent généralement une dégradation et, jusqu’à présent, leur objectif était inconnu et considéré comme insignifiant. Cependant, Michaeli et son équipe ont montré que ces domaines sont en fait utilisés pour produire la traduction régulatrice de l’ARNc, une fonction jamais connue auparavant pour se produire dans les trypanosomes. «Ces organismes ont trouvé une localisation spéciale pour l’ARNc. Ce nouveau ncRNA interagit avec l’ARNr lorsqu’il est formé dans le noyau et se déplace avec lui vers le cytoplasme, où la traduction et la synthèse des protéines ont lieu », a expliqué Michaeli.
Sa méthode capture l’interaction entre l’ARNc et l’ARNm et est basée sur la réticulation par rayonnement ultraviolet. «Nous pouvons ensuite séquencer ces molécules hybrides afin de savoir quelles molécules interagissent les unes avec les autres. C’est très élégant, car cela nous permet de découvrir quels gènes sont régulés par ces nouveaux ARN non codants basés sur l’idée « Dites-moi avec qui vous interagissez ou qui sont vos amis, et je vous dirai qui vous êtes. ‘ Nous avons pu élucider l’ARNc de telle sorte que nous puissions en apprendre davantage sur les molécules avec lesquelles ils interagissent et régulent. »
Cette découverte chez une espèce a conduit Michaeli à croire qu’elle peut également être commune à toute la famille des parasites et peut même exister dans d’autres organismes. «Il y a des années, les gens appelaient les introns (informations épissées de l’ARN lors de sa maturation) de l’ARNm, bien qu’il ait été découvert par la suite que ces introns transportaient des informations pour les ARN non codants. Cependant, personne n’a jamais suggéré que l’ARNc existe dans les introns d’ARNr », a ajouté Michaeli.
L’équipe espère que leur découverte conduira au développement de nouveaux médicaments basés sur l’ARN antisens pour traiter et prévenir la propagation des maladies causées par les trypanosomes. La thérapie à l’ARN sera utile à l’avenir pour de nombreuses maladies, y compris les maladies infectieuses, car celles-ci peuvent être utilisées pour interférer avec leur fonction régulatrice. En effet, le récent succès de la délivrance d’ARN dans les vaccins Pfizer et Moderna pour COVID-19 est prometteur pour cette approche biotechnologique.