Le lien entre ces agents pathogènes est resté caché jusqu’aux années 1960, lorsque des chercheurs du Royaume-Uni et des États-Unis ont isolé deux virus avec des structures en forme de corona qui ont causé des rhumes communs chez l’homme. Les scientifiques ont rapidement remarqué que les virus identifiés chez les animaux malades avaient la même structure hérissée, constellée de bosses protéiques pointues. Sous les microscopes électroniques, ces virus ressemblaient à la couronne solaire, ce qui a incité les chercheurs en 1968 à inventer le terme coronavirus pour l’ensemble du groupe.
Maintenant, alors que le nombre de décès dus à la pandémie de COVID-19 augmente, les chercheurs s’efforcent de découvrir autant que possible la biologie du dernier coronavirus , appelé SARS-CoV-2. Un profil de tueur émerge déjà. Les scientifiques apprennent que le virus a développé une série d’adaptations qui le rendent beaucoup plus mortel que les autres coronavirus que l’humanité a connus jusqu’à présent .
Contrairement à ses proches parents, le SRAS-CoV-2 peut facilement attaquer les cellules humaines en plusieurs points, les poumons et la gorge étant les principales cibles. Une fois à l’intérieur du corps, le virus utilise un arsenal diversifié de molécules dangereuses.Et les preuves génétiques suggèrent qu’il se cache dans la nature depuis peut-être des décennies .
Mais il existe de nombreuses inconnues cruciales sur ce virus, notamment comment il tue exactement, s’il deviendra plus ou moins mortel et ce qu’il peut révéler au sujet de la prochaine épidémie dans la famille des coronavirus.
« Il y en aura plus, que ce soit sur le marché ou en préparation », explique Andrew Rambaut, qui étudie l’évolution virale à l’Université d’Edimbourg, au Royaume-Uni.
La famille maléfique des coronavirus
Parmi les virus qui attaquent les humains, les coronavirus sont de grande taille. À 125 nanomètres de diamètre, ils sont également relativement grands pour les virus qui utilisent l’ARN pour se répliquer, le groupe qui représente la plupart des maladies émergentes. Mais les coronavirus se distinguent vraiment par leurs génomes. Avec 30 000 bases génétiques, les coronavirus ont les plus grands génomes de tous les virus à ARN . Leurs génomes sont plus de trois fois plus importants que ceux du VIH et de l’hépatite C, et plus de deux fois plus importants que ceux de la grippe.
La recombinaison se produit souvent chez les chauves-souris, qui portent 61 virus, connus pour infecter les humains; certaines espèces abritent jusqu’à 12. Dans la plupart des cas, les virus ne nuisent pas aux chauves-souris, et il existe plusieurs théories sur les raisons pour lesquelles le système immunitaire des chauves-souris peut faire face à ces envahisseurs. Un document publié en février affirme que les cellules de chauve-souris infectées par le virus libèrent rapidement un signal qui leur permet d’héberger le virus sans le tuer .
Les estimations de la naissance du premier coronavirus varient considérablement, d’il y a 10 000 ans à 300 millions d’années. Les scientifiques connaissent maintenant des dizaines de souches, dont sept infectent les humains. Parmi les quatre causes de rhume, deux (OC43 et HKU1) proviennent de rongeurs et les deux autres (229E et NL63) de chauves-souris. Les trois maladies graves – SARS-CoV (la cause du SRAS), syndrome respiratoire du Moyen-Orient MERS-CoV et SARS-CoV-2 – provenaient toutes de chauves-souris.
Mais les scientifiques pensent qu’il existe généralement un intermédiaire, un animal infecté par des chauves-souris qui transmet le virus à l’homme . Dans le cas du SRAS, l’intermédiaire serait des chats civettes, qui sont vendus sur les marchés chinois des animaux vivants.
L’origine du SRAS-CoV-2 reste une question ouverte. Le virus partage 96% de son matériel génétique avec un virus trouvé dans une chauve-souris dans une grotte du Yunnan, en Chine – un argument convaincant qu’il provient de chauves-souris, selon les chercheurs. Mais il y a une différence cruciale. Les protéines de pointe des coronavirus ont une unité appelée domaine de liaison aux récepteurs, qui est essentielle pour leur succès à pénétrer dans les cellules humaines. Le domaine de liaison du SRAS-CoV-2 est particulièrement efficace et diffère considérablement du virus de la chauve-souris du Yunnan , qui ne semble pas infecter l’homme.
Pour compliquer les choses, un fourmilier écailleux nommé pangolin est apparu avec un coronavirus qui avait un domaine de liaison aux récepteurs presque identique à celui de la version humaine. Mais le reste du coronavirus n’était génétiquement similaire qu’à 90%, donc certains chercheurs soupçonnent que le pangolin n’était pas l’intermédiaire. Le fait que les mutations et les recombinaisons fonctionnent complique les efforts pour dessiner un arbre généalogique.
Mais des études publiées ces derniers mois, qui n’ont pas encore été examinées par des pairs, suggèrent que le SRAS-CoV-2 – ou un ancêtre très similaire – se cache chez certains animaux depuis des décennies. Selon un document publié en ligne en mars, la lignée de coronavirus qui a conduit au SARS-CoV-2 s’est séparée il y a plus de 140 ans de celle étroitement liée observée aujourd’hui chez les pangolins.
Puis, au cours des 40 à 70 dernières années, les ancêtres du SRAS-CoV-2 se sont séparés de la version de la chauve-souris, qui a par la suite perdu le domaine de liaison au récepteur efficace qui était présent chez leurs ancêtres (et qui reste dans SARS-CoV-2). Une étude publiée le 21 avril est arrivée à des conclusions très similaires en utilisant une méthode de datation différente.
Ces résultats suggèrent une longue histoire familiale, avec de nombreuses branches de coronavirus de chauve-souris et peut-être des pangolins portant le même domaine mortel de liaison aux récepteurs que le SRAS-CoV-2, y compris certains qui pourraient avoir des capacités similaires à provoquer une pandémie, explique Rasmus Nielsen. , biologiste évolutionniste à l’Université de Californie, Berkeley, et co-auteur de la deuxième étude. « Il est nécessaire de continuer à surveiller et à accroître la surveillance de l’émergence de nouvelles souches virales par transfert zoonotique », dit-il.
Deux portes ouvertes
Bien que les coronavirus humains connus puissent infecter de nombreux types de cellules, ils provoquent tous principalement des infections respiratoires. La différence est que les quatre causes du rhume attaquent facilement les voies respiratoires supérieures, tandis que le MERS-CoV et le SRAS-CoV ont plus de difficulté à s’y maintenir, mais réussissent mieux à infecter les cellules pulmonaires.
Le SRAS-CoV-2, malheureusement, peut faire les deux très efficacement. Cela lui donne deux endroits pour s’installer, explique Shu-Yuan Xiao, pathologiste à l’Université de Chicago, Illinois. La toux d’un voisin qui envoie dix particules virales sur son chemin pourrait suffire à déclencher une infection de la gorge , mais les cils capillaires trouvés là-bas sont susceptibles de faire leur travail et d’éliminer les envahisseurs. Si le voisin est plus proche et tousse 100 particules vers vous, le virus pourrait atteindre les poumons, explique Xiao.
Ces capacités variables pourraient expliquer pourquoi les personnes atteintes de COVID-19 ont des expériences si différentes. Le virus peut commencer dans la gorge ou le nez, provoquer une toux et altérer le goût et l’odeur, puis s’arrêter là. Ou il peut descendre dans les poumons et affaiblir cet organe. On ne sait pas comment il y arrive, s’il se déplace cellule par cellule ou s’il est emporté d’une manière ou d’une autre, explique Stanley Perlman, immunologiste à l’Université de l’Iowa à Iowa City qui étudie les coronavirus.
Clemens-Martin Wendtner, médecin spécialiste des maladies infectieuses à la Schwabing Clinic de Munich, en Allemagne, dit que cela pourrait être un problème du système immunitaire qui permet au virus de s’infiltrer dans les poumons. La plupart des personnes infectées créent des anticorps neutralisants qui sont adaptés par le système immunitaire pour se lier au virus et l’empêcher de pénétrer dans une cellule.
Mais certaines personnes semblent incapables de les fabriquer, explique Wendtner. C’est peut-être la raison pour laquelle certains guérissent après une semaine de symptômes bénins, tandis que d’autres sont touchés par une maladie pulmonaire d’apparition tardive. Mais le virus peut également contourner les cellules de la gorge et aller directement aux poumons.
Ensuite, les patients peuvent contracter une pneumonie sans les symptômes bénins habituels, comme une toux ou une faible fièvre, qui seraient autrement les premiers, explique Wendtner. Le fait d’avoir ces deux points d’infection signifie que le SRAS-CoV-2 peut mélanger la transmissibilité des coronavirus du rhume avec la létalité du MERS-CoV et du SARS-CoV. « C’est une combinaison malheureuse et dangereuse de cette souche de coronavirus », dit-il.
La capacité du virus à infecter activement et à se reproduire dans les voies respiratoires supérieures était quelque peu surprenante, étant donné que son proche parent génétique, le SRAS-CoV, n’a pas cette capacité . Le mois dernier, Wendtner a publié les résultats d’expériences au cours desquelles son équipe a pu cultiver le virus à partir de la gorge de neuf personnes atteintes de COVID-19, montrant que le virus s’y reproduit et s’infecte activement.
Cela explique une différence cruciale entre les proches parents. Le SRAS-CoV-2 peut répandre des particules virales de la gorge dans la salive avant même le début des symptômes, et ceux-ci peuvent facilement passer d’une personne à l’autre.. Le SRAS-CoV était beaucoup moins efficace pour faire ce saut, ne passant que lorsque les symptômes étaient complets, ce qui le rendait plus facile à contenir.
Ces différences ont créé une certaine confusion quant à la létalité du SRAS-CoV-2. Certains experts et rapports des médias le décrivent comme moins mortel que le SRAS-CoV car il tue environ 1% des personnes qu’il infecte, tandis que le SARS-CoV tue à un taux environ dix fois plus élevé. Mais Perlman dit que c’est la mauvaise façon de voir les choses. Le SRAS-CoV-2 infecte beaucoup mieux les gens, mais bon nombre des infections ne progressent pas vers les poumons. « Une fois qu’il atteint les poumons, il est probablement tout aussi mortel », dit-il.
Ce qu’il fait lorsqu’il atteint les poumons est semblable à certains égards à ce que font les virus respiratoires, bien que beaucoup soit encore inconnu. Comme le SRAS-CoV et la grippe, il infecte et détruit les alvéoles, les minuscules sacs dans les poumons qui transportent l’oxygène dans la circulation sanguine. Lorsque la barrière cellulaire qui sépare ces sacs des vaisseaux sanguins est brisée, le liquide dans les vaisseaux fuit, empêchant l’oxygène d’atteindre le sang.
D’autres cellules, y compris les globules blancs, bloquent davantage les voies respiratoires. Une réponse immunitaire robuste effacera tout cela chez certains patients, mais une réaction excessive du système immunitaire peut aggraver les lésions tissulaires .Si l’inflammation et les lésions tissulaires sont trop graves, les poumons ne se rétablissent jamais et la personne meurt ou se retrouve avec les poumons cicatrisés , dit Xiao. « D’un point de vue pathologique, nous ne voyons pas beaucoup d’unicité ici. »
Et comme pour le SRAS-CoV, le MERS-CoV et les coronavirus animaux, les dommages ne s’arrêtent pas dans les poumons. Une infection par le SRAS-CoV-2 peut déclencher une réponse immunitaire excessive connue sous le nom de tempête de cytokines, qui peut entraîner la défaillance de plusieurs organes et la mort.
Le virus peut également infecter les intestins, le cœur, le sang, les spermatozoïdes (comme le MERS-CoV), les yeux et peut-être le cerveau. Les dommages aux reins, au foie et à la rate observés chez les personnes atteintes de COVID-19 suggèrent que le virus peut être transporté dans le sang et infecter divers organes ou tissusdit Guan Wei-jie, pneumologue à l’Institut de santé respiratoire de l’Université médicale de Guangzhou, en Chine, une institution louée pour son rôle dans la lutte contre le SRAS et le COVID-19. Le virus peut être capable d’infecter divers organes ou tissus où que l’approvisionnement en sang arrive, dit Guan.
Mais alors que le matériel génétique du virus apparaît dans ces différents tissus, on ne sait toujours pas si les dommages y sont causés par le virus ou par une tempête de cytokines, dit Wendtner. «Les autopsies sont effectuées dans notre centre. Il y aura bientôt plus de données », dit-il.
Qu’il infecte la gorge ou les poumons, le SRAS-Cov-2 brise la membrane protectrice des cellules hôtes en utilisant ses protéines de pointe. Premièrement, le domaine de liaison au récepteur de la protéine se lie à un récepteur appelé ACE2, qui est situé à la surface de la cellule hôte. L’ACE2 est exprimé dans tout le corps dans la muqueuse des artères et des veines qui traversent tous les organes, mais est particulièrement dense dans les cellules qui tapissent les alvéoles et l’intestin grêle.
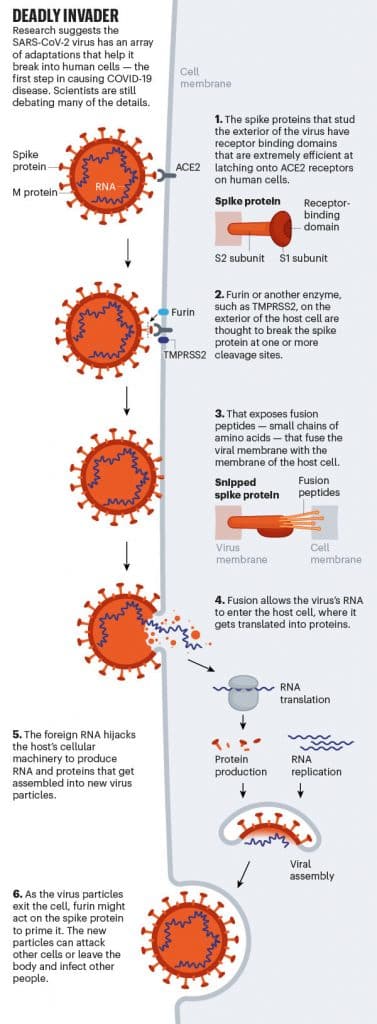
Bien que les mécanismes exacts restent inconnus, les preuves suggèrent qu’après la fixation du virus, la cellule hôte coupe la protéine de pointe à l’un de ses « sites de clivage » dédiés, exposant les peptides de fusion – de minuscules chaînes d’acides aminés qui aident pour ouvrir la membrane de la cellule hôte afin que la membrane virale puisse fusionner avec elle. Une fois que le matériel génétique de l’envahisseur pénètre dans la cellule, le virus prend le contrôle de la machinerie moléculaire de l’hôte pour produire de nouvelles particules virales. Ensuite, cette descendance quitte la cellule pour aller en infecter d’autres.
Les épines évoluées
SARS-CoV-2 est spécialement équipé pour forcer l’entrée dans les cellules. Le SARS-CoV et le SARS-CoV-2 se lient tous deux à ACE2, mais le domaine de liaison aux récepteurs du SARS-CoV-2 est particulièrement restreint. Il est 10 à 20 fois plus susceptible de se lier à l’ACE2 qu’au SARS-CoV. Wendtner dit que le SRAS-CoV-2 est si bon pour infecter les voies respiratoires supérieures qu’il pourrait même y avoir un deuxième récepteur que le virus pourrait utiliser pour lancer son attaque.
Plus inquiétant encore est le fait que le SRAS-CoV-2 semble utiliser l’enzyme furine hôte pour couper la protéine virale de la pointe. Cela est préoccupant, disent les chercheurs, car la furine est abondante dans les voies respiratoires et se trouve dans tout le corps. Il est utilisé par d’autres virus redoutables, dont le VIH, la grippe, la dengue et le virus Ebola, pour pénétrer dans les cellules . En revanche, les molécules de division utilisées par le SRAS-CoV sont beaucoup moins courantes et moins efficaces.
Les scientifiques pensent que l’implication de la furine pourrait expliquer pourquoi le SRAS-CoV-2 est si bon pour sauter de cellule en cellule, de personne à personne, et peut-être d’animal à humain. Robert Garry, virologue à l’Université Tulane de la Nouvelle-Orléans, en Louisiane, estime qu’il donne au SARS-CoV-2 100 à 1 000 fois plus de chances que le SARS-CoV d’atteindre profondément les poumons. « Quand j’ai vu que le SARS-CoV-2 avait ce site de clivage, je n’ai pas très bien dormi cette nuit-là », dit-il.
Le mystère est d’où proviennent les instructions génétiques pour ce site de division particulier. Bien que le virus les ait probablement obtenus par recombinaison, cette configuration particulière n’a jamais été trouvée dans aucun autre coronavirus d’aucune espèce . La détermination de son origine pourrait être la dernière pièce du puzzle qui déterminera quel animal a été le tremplin qui a permis au virus d’atteindre les humains.
Fin du jeu
Certains chercheurs espèrent que le virus s’affaiblira avec le temps grâce à une série de mutations qui l’adaptent pour persister chez l’homme. Avec cette logique, il deviendrait moins mortel et plus susceptible de se propager. Mais les chercheurs n’ont pas encore trouvé de signes d’un tel affaiblissement, probablement en raison du mécanisme de réparation génétique efficace du virus. « Le génome du virus COVID-19 est très stable, et je ne vois aucun changement de pathogénicité causé par la mutation du virus », explique Guo Deyin, qui étudie les coronavirus à l’Université Sun Yat-sen de Guangzhou.
Rambaut doute également que le virus devienne plus doux avec le temps et n’affecte pas son hôte. « Ça ne marche pas comme ça », dit-il. Tant qu’il peut infecter avec succès de nouvelles cellules, se reproduire et se propager à de nouvelles, peu importe si cela fait mal à l’hôte, dit-il.
Mais d’autres pensent qu’il existe une possibilité d’un meilleur résultat. Cela pourrait donner aux gens des anticorps qui offrent une protection au moins partielle, explique Klaus Stöhr, qui dirigeait la division de recherche et d’épidémiologie du SRAS de l’Organisation mondiale de la santé. Stöhr dit que l’immunité ne sera pas parfaite – les personnes qui se réinfectent continueront à développer des symptômes mineurs, comme elles le font maintenant avec le rhume, et il y aura de rares exemples de maladie grave. Mais le mécanisme de correction du virus signifie qu’il ne mute pas rapidement et que les personnes infectées conserveront une forte protection, dit-il.
« De loin, le scénario le plus probable est que le virus continuera de se propager et d’infecter la plupart de la population mondiale dans un laps de temps relativement court », explique Stöhr, ce qui signifie un à deux ans. « Plus tard, le virus continuera de se propager dans la population humaine, probablement pour toujours. » Comme les quatre coronavirus humains généralement bénins, le SRAS-CoV-2 circulerait alors constamment et provoquerait principalement des infections bénignes des voies respiratoires supérieures, explique Stöhr. Pour cette raison, ajoute-t-il, les vaccins ne seront pas nécessaires.
Certaines études antérieures soutiennent cet argument. L’un d’eux a montré que lorsque les gens étaient inoculés avec le coronavirus froid commun 229E, leurs niveaux d’anticorps atteignaient un pic deux semaines plus tard et ne montaient que légèrement après un an. Cela n’a pas empêché les infections un an plus tard, mais les infections subséquentes ont entraîné moins de symptômes, voire aucun, et une période plus courte d’excrétion de virus.
Le coronavirus OC43 fournit un modèle de l’orientation de cette pandémie. Ce virus donne également des rhumes communs aux humains, mais les recherches génétiques de l’Université de Louvain en Belgique suggèrent que l’OC43 pourrait avoir été un tueur dans le passé. Cette étude indique que l’OC43 s’est propagé aux humains vers 1890 par le biais de vaches, qu’ils ont obtenues de souris. Les scientifiques suggèrent que l’OC43 était responsable d’une pandémie qui a tué plus d’un million de personnes dans le monde en 1889-90 – une épidémie qui était auparavant attribuée à la grippe. Aujourd’hui, l’OC43 continue de circuler largement, et il se pourrait que l’exposition continue au virus garde la grande majorité des gens à l’abri.
Mais même si ce processus a rendu l’OC43 moins meurtrier, on ne sait toujours pas si quelque chose de similaire se produirait avec le SRAS-CoV-2. Une étude sur des singes a montré qu’ils conservaient des anticorps dirigés contre le SRAS-CoV-2, mais les chercheurs n’ont rendu compte que des 28 premiers jours après l’infection, ce qui rend difficile la durée de l’immunité. Les concentrations d’anticorps contre le SRAS-CoV ont également diminué de manière significative sur une période de deux à trois ans. Il n’a pas été prouvé que ces niveaux réduits seraient suffisants pour prévenir l’infection ou réduire la gravité. Les chats, les vaches, les chiens et les poulets ne semblent pas à l’abri des coronavirus parfois mortels qui les infectent, de sorte que les vétérinaires, au fil des ans, doivent se battre pour des vaccins.
De nombreux scientifiques se demandent si les coronavirus apprivoisés ont jamais été aussi virulents que le SRAS-CoV-2. Les gens aiment penser que « les autres coronavirus étaient terribles et sont devenus doux », explique Perlman. « C’est une façon optimiste de penser à ce qui se passe actuellement, mais nous n’avons aucune preuve. »